Zoutzuur: Atoomeconomie, Rendement en E-factor

 In de natronloog productieruimte hebben we het al over Duurzame Chemie gehad.
In de natronloog productieruimte hebben we het al over Duurzame Chemie gehad.
Ik zal het nog even herhalen.
![]() Samengevat komt Duurzame Chemie ofwel Groene Chemie hierop neer:
Samengevat komt Duurzame Chemie ofwel Groene Chemie hierop neer:
| Duurzame chemische processen: | Manieren om chemische processen duurzamer te maken: |
|
|
 Je gaat nu oefenen met drie specifieke factoren waarmee je een productieproces op duurzaamheid kunt beoordelen. De PALstudent zal je hierbij helpen door je drie factoren uit te leggen en je daarover vragen te stellen.
Je gaat nu oefenen met drie specifieke factoren waarmee je een productieproces op duurzaamheid kunt beoordelen. De PALstudent zal je hierbij helpen door je drie factoren uit te leggen en je daarover vragen te stellen.
Het gaat om de volgende factoren:
- Atoomeconomie
- Rendement
- de E-factor (Environmental-factor)
Als je geoefend hebt, gaan we deze factoren gebruiken om de twee productiemethoden voor zoutzuur langs de meetlat te leggen.
 Een belangrijk uitgangspunt van duurzame chemie is, dat je wilt dat zoveel mogelijk van de grondstoffen terecht komen in het gewenste eindproduct.
Een belangrijk uitgangspunt van duurzame chemie is, dat je wilt dat zoveel mogelijk van de grondstoffen terecht komen in het gewenste eindproduct.
Andersom gezegd: je wilt dat zo min mogelijk afval of bijproducten ontstaan in het productieproces.
![]() Hiervoor kun je de factor Atoomeconomie gebruiken:
Hiervoor kun je de factor Atoomeconomie gebruiken:
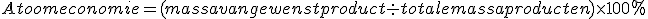
Laten we bijvoorbeeld kijken naar de synthese van calciumoxide. Hiervoor wordt calciumcarbonaat verhit in een oven en ontstaat er behalve calciumoxide ook koolstofdioxide.
 De reactievergelijking is dan:
→
+
De reactievergelijking is dan:
→
+
De atoomeconomie voor deze reactie is dan, afgerond op een geheel getal:
%
Nog een ander voorbeeld: ijzer wordt uit ijzererts gehaald met behulp van koolstof: 2 Fe2O3 + 3C → 4 Fe + 3 CO2
 Wat is van deze reactie de atoomeconomie, afgerond op een geheel getal?
%
Wat is van deze reactie de atoomeconomie, afgerond op een geheel getal?
%
Titanium kan bijvoorbeeld op twee manieren uit haar erts worden gehaald:
- door reactie met een metaal dat een sterkere reductor is dan titanium zelf: TiO2 + 2 Mg → Ti + 2 MgO
- door elektrolyse: TiO2 → Ti + O2
 De atoomeconomie van reactie 1 is:
% (afgrond op een geheel getal)
De atoomeconomie van reactie 1 is:
% (afgrond op een geheel getal)
De atoomeconomie van reactie 2 is:
% (afgrond op een geheel getal)
Welk proces is nu duurzamer, proces 1 of 2?
 OK, op papier kan Atoomeconomie een heel goede indruk geven van de duurzaamheid van een proces.
OK, op papier kan Atoomeconomie een heel goede indruk geven van de duurzaamheid van een proces.
Kijk maar eens naar de productie van ammoniak: N2 + 3H2 → 2NH3, dus 100% atoomeconomie, want alle atomen uit de grondstoffen komen terecht in het gewenste eindproduct!
Even tussendoor: had je trouwens nu eigenlijk al stage gelopen in de ammoniak-productieruimte? Mijn geheugen is wat dat betreft niet zo goed geprogrammeerd...
In ieder geval, als je daar al hebt stage gelopen, weet je dat de opbrengst per hoeveelheid aangeleverde grondstoffen niet hoger dan 15% wordt.
![]() Dus behalve atoomeconomie moet dan ook worden rekening gehouden worden met het Rendement:
Dus behalve atoomeconomie moet dan ook worden rekening gehouden worden met het Rendement: 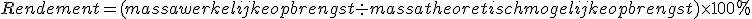
Laten we kijken naar het produceren van SO2 uit zwavel: S + O2 → SO2, atoomeconomie 100%
 Als uit 12 gram zwavel 21 gram zwaveldioxide wordt geproduceerd, wat is dan het rendement, afgerond op een geheel getal?
%
Als uit 12 gram zwavel 21 gram zwaveldioxide wordt geproduceerd, wat is dan het rendement, afgerond op een geheel getal?
%
Nog een rendementsberekening:
Stel dat uit 1,0 ton ijzererts via de reactie 2 Fe2O3 + 3C → 4 Fe + 3 CO2 0,50 ton ijzer kan worden gehaald.
 Dan is het rendement van dit proces
% (afgerond op een geheel getal).
Dan is het rendement van dit proces
% (afgerond op een geheel getal).
 Om de atoomeconomie in relatie tot het rendement te kunnen meenemen in het beoordelen van de duurzaamheid van een proces, is er de Environmental factor, de E-factor.
Om de atoomeconomie in relatie tot het rendement te kunnen meenemen in het beoordelen van de duurzaamheid van een proces, is er de Environmental factor, de E-factor.
![]() De E-factor is de hoeveelheid afval per kg product:
De E-factor is de hoeveelheid afval per kg product: ![]()
Goed, laten we nog eens kijken naar de productie van titanium via de twee verschillende methodes:
- TiO2 + 2 Mg → Ti + 2 MgO
- TiO2 → Ti + O2
 Bereken de E-factor, als het rendement van beide processen 100% zou zijn.
Bereken de E-factor, als het rendement van beide processen 100% zou zijn.
Geef je antwoorden met twee cijfers achter de komma.
| E-factor bij 100% Rendement (kg afval per kg product) |
|
| Methode 1 | |
| Methode 2 |
 Bereken nu eens de E-factor, als het rendement van beide processen 50% zou zijn.
Bereken nu eens de E-factor, als het rendement van beide processen 50% zou zijn.
| E-factor bij 50% Rendement (kg afval per kg product) |
|
| Methode 1 | |
| Methode 2 |
Stel nu eens dat methode 2 een rendement heeft van 50%.
 Even een uitdaginkje: bereken bij welk
minimale rendement van proces 1, zou proces 1 toch duurzamer zijn wat
betreft de E-factor.
Even een uitdaginkje: bereken bij welk
minimale rendement van proces 1, zou proces 1 toch duurzamer zijn wat
betreft de E-factor.
Het rendement dat proces 1 dan minimaal zou moeten hebben is:
% (afgerond op een heel getal)
 Enne... niet te gauw op "Verzenden/Toon antwoorden" klikken, he.
Enne... niet te gauw op "Verzenden/Toon antwoorden" klikken, he. Dat zorgt voor een laag Leer-Rendement en een hoge E-factor en is dus niet Duurzaam.
 Zo, nu ben je wel weer even helemaal murw-gerekend, schat ik zo in.
Zo, nu ben je wel weer even helemaal murw-gerekend, schat ik zo in.
 Kopieer als laatste de formules van Atoomeconomie, Rendement en E-factor nog even naar je
Kopieer als laatste de formules van Atoomeconomie, Rendement en E-factor nog even naar je ![]() labjournaal, dan heb je ze bij de hand.
labjournaal, dan heb je ze bij de hand.
Of staan ze tegenwoordig al in je Binas?